歡迎來到醫(yī)療器械領(lǐng)域:多米諾專家對話,我們的新系列著眼于探討醫(yī)療器械,國際法規(guī)和生命科學制造行業(yè)的最新新聞。
在本系列的第一期中,我們的噴碼機專家小組將重點討論即將出臺的歐盟醫(yī)療器械法規(guī),解析患者、醫(yī)院和醫(yī)療器械制造商面臨的一些主要挑戰(zhàn)和機遇。
專家小組

Craig Stobie,全球行業(yè)總監(jiān)
Bart Vansteenkiste,全球生命科學部門經(jīng)理
Volker Watzke,歐盟醫(yī)療器械部門經(jīng)理
什么是歐盟醫(yī)療器械法規(guī)?
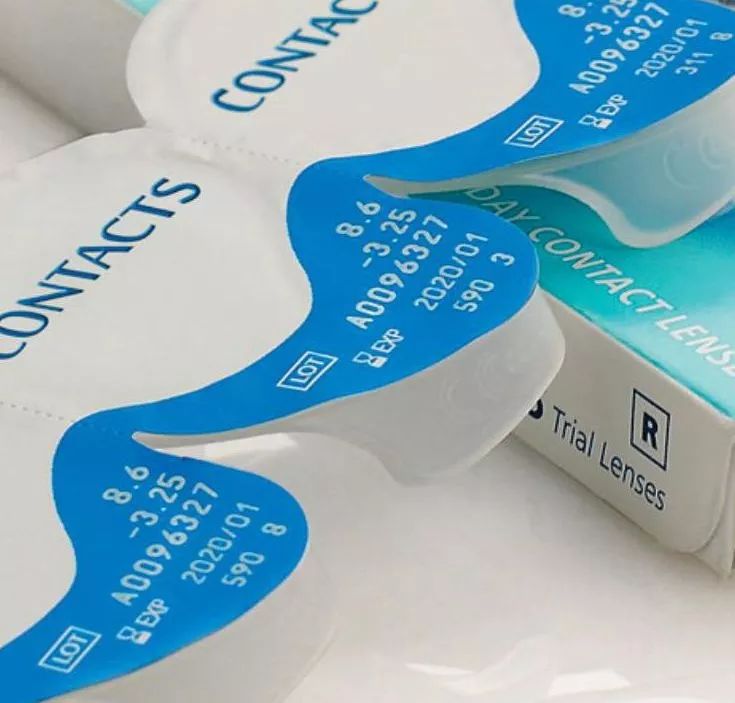
從2022年5月26日起,在歐盟成員國銷售的所有醫(yī)療設(shè)備都需要包含UDI,并需要記錄在EUDAMED的歐盟數(shù)據(jù)庫中,即歐洲醫(yī)療器械數(shù)據(jù)庫。隨著這些法規(guī)的生效,制造商需要為在包裝上賦可追溯碼尋求一種解決方案。
買家和醫(yī)院有義務(wù)拒絕未達到此標準的產(chǎn)品。這意味著,所有想要向歐盟銷售產(chǎn)品的制造商,即使在歐洲以外的國家都需要滿足這些要求。
醫(yī)療器械制造商還需要確保每個產(chǎn)品的UDI都在歐盟數(shù)據(jù)庫中有注冊記錄。不然,制造商將不再能夠向其他歐盟成員國銷售其產(chǎn)品。

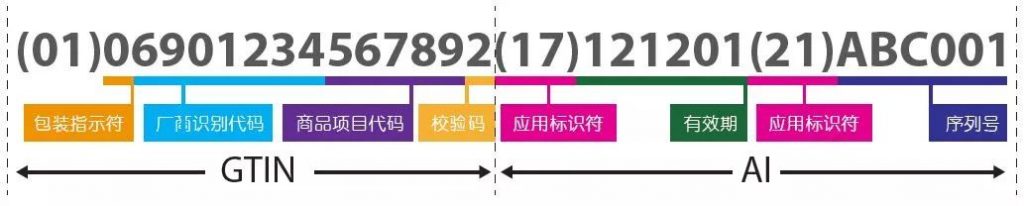
這個數(shù)據(jù)庫守護著患者的安全。
Watzke:我最近讀到的一篇文章說道,大多數(shù)當局不知道有多少醫(yī)療器械在他們的國家出售。例如,德國不知道這個數(shù)字,可能在70萬至150萬之間。
互聯(lián)世界
醫(yī)療行業(yè)正處于從手動記錄數(shù)據(jù)到數(shù)字記錄數(shù)據(jù)的轉(zhuǎn)變中,有關(guān)互聯(lián)醫(yī)療設(shè)備的數(shù)據(jù)也有所增加。醫(yī)療器械發(fā)展協(xié)會最近發(fā)表的一篇文章,即軟件與召回峰值,說到由于設(shè)備軟件問題導致醫(yī)療設(shè)備召回的問題不斷增加,引發(fā)了對患者安全潛在問題的討論。
Vanstenkiste:隨著這些設(shè)備的互聯(lián),并接入物聯(lián)網(wǎng),這會帶來額外的風險嗎?比如說如果我有一臺電腦,我知道你有一個醫(yī)療產(chǎn)品,并且它是連接到互聯(lián)網(wǎng)的,可能,我會嘗試訪問你的醫(yī)療設(shè)備并作一些不利的事情。
毫無疑問,這是一個需要考慮的問題,但醫(yī)療器械在面臨高風險處理時變得更智能,減少患者的風險。不過這些處理會損耗機器壽命,因此必須更加注重維護。

另一個有趣的問題是互聯(lián)醫(yī)療設(shè)備的隱私保護。對于包含關(guān)于您和您的醫(yī)療健康保險的數(shù)據(jù)的醫(yī)療設(shè)備,是否有任何訪問的規(guī)定和限制?
Watzke:不同的國家有不同的數(shù)據(jù)法規(guī)。在一些國家(如德國),訪問數(shù)據(jù)可能更容易,而其他德語國家可能面臨更嚴峻的數(shù)據(jù)監(jiān)管問題。在某些國家/地區(qū),產(chǎn)品與患者之間的聯(lián)系可能相當困難。
如果隱私法由設(shè)備原產(chǎn)國規(guī)定,那么是否會對已連接醫(yī)療設(shè)備的旅行者造成影響?如果患者前往其他國家度假,但數(shù)據(jù)不可用,是否會導致問題?
Watzke:我認為信息應該記錄并保存在某處,也許在芯片卡上。無論患者身在何處,只要能提供數(shù)據(jù),就能獲得最佳的藥品、醫(yī)療保健和醫(yī)生服務(wù),保證患者的利益。
訪問需要被允許,隱私也需要得到尊重。這為醫(yī)療設(shè)備軟件和醫(yī)療設(shè)備連接的互操作性增加了一個全新的維度。
Vansteenkiste:我認為,如果數(shù)據(jù)可以從世界上任何地方的任何醫(yī)院獲得,那將會是好事。但是,就不同的立法而言,我認為,如果您攜帶所有數(shù)據(jù)在世界各地旅行,并且人們突然可以訪問您的個人信息,那么可能會帶來一些問題。
倒計時開始
在類似行業(yè),我們看到行業(yè)機構(gòu)會就即將出臺的法規(guī)向會員提供專業(yè)的咨詢服務(wù)。例如,EMBO和歐洲藥品能傳達很明確的建議給其成員。醫(yī)療設(shè)備是否也有這樣的機構(gòu)?
Watzke:有一個機構(gòu),MedTech,這是醫(yī)療器械行業(yè)的專業(yè)機構(gòu)。然而,由于我們有這么多的分支,所以讓大家都聚集在一起比較困難。
政客最近發(fā)表了一篇文章,“歐盟醫(yī)療器械法規(guī)問題”,討論了一些新歐盟MDR的議題,包括執(zhí)行日期,現(xiàn)有的產(chǎn)品的重新注冊問題。這迫使制造商利用保留條款推遲認證產(chǎn)品,并為自己爭取更多時間來合規(guī)。
監(jiān)管總監(jiān)Oliver Bisazza也警告說,在2022年的最后期限之前,即使一些現(xiàn)在被廣泛使用的醫(yī)療設(shè)備也可能會被停止使用。
Watzke:迫使大多數(shù)中小型企業(yè)來遵守法律,將是一個巨大的挑戰(zhàn)。
由于新的要求和新的立法,這有可能影響產(chǎn)品的供應。有一個潛在的解決方案:可以是將某些產(chǎn)品的合規(guī)性期限移后。
Watzke:我們已經(jīng)在美國看到過這種情況,一類產(chǎn)品的最后期限已經(jīng)推遲了兩年,從2018年推遲到2020年。
創(chuàng)新的阻礙
即將到來的最后期限并不是一些制造商面臨的唯一問題,還有許多初創(chuàng)企業(yè)甚至都難以進入市場。這在很大程度上是由于沒有公告機構(gòu)—歐盟認證的組織,在產(chǎn)品投放市場之前先評估合格性。
英國的BSI是第一個被認可的公告機構(gòu)。歐洲聯(lián)盟其他50個公告機構(gòu)仍在等待認證。與此同時,歐盟也公告了另外三個公告機構(gòu)(TüVSüd,Dekra IMQ)。根據(jù)《醫(yī)療器械指令》和《有源植入類醫(yī)療器械指令》,最初的57個公告機構(gòu)中,只有38個根據(jù)醫(yī)療器械法規(guī)申請認證,而且這個數(shù)字正在下降。
隨著越來越少的公告機構(gòu)可以咨詢,現(xiàn)在很難對新產(chǎn)品進行認證。特別是當你是一個初創(chuàng)公司,不為人所知,并且與這些機構(gòu)也沒有合作過。
Vansteenkiste:同樣,這也會對歐洲市場上允許銷售的現(xiàn)有產(chǎn)品產(chǎn)生影響。最后期限和制造商必須重新注冊所有現(xiàn)有產(chǎn)品的事實可能會導致市場上產(chǎn)品缺乏。
Watzke:立法規(guī)定,已經(jīng)按照舊指令注冊的產(chǎn)品正面臨過渡期。市場上已有的一些產(chǎn)品可能會使用舊證書再持續(xù)銷售兩到四年。
更復雜的是,不同等級的產(chǎn)品有不同的要求和最后期限。
Vanstenkiste:作為制造商,您可能有一組產(chǎn)品即將到達最終日期,但您可能還有另外一組非常相似的產(chǎn)品,它們可能在兩年、三年或四年內(nèi)才到達最終日期。
標準缺乏一致性,事情變得更加復雜。

Watzke:有些產(chǎn)品被歸類為III類產(chǎn)品,因為產(chǎn)品對患者有高風險,但在美國可能不是III類。此外,某些產(chǎn)品在美國并非醫(yī)療器械,在歐洲,是屬于醫(yī)療器械。對于已經(jīng)申請并在美國注冊的制造商來說,這是另一個挑戰(zhàn)。
在其它行業(yè),我們看到行業(yè)機構(gòu)向他們的成員提供咨詢建議,但醫(yī)療器械行業(yè)卻還未如此,事實證明,很難將不同分支的公司聚集在一起。
歐洲MedTech機構(gòu),醫(yī)療器械行業(yè)的專業(yè)機構(gòu),目前僅服務(wù)非常大的公司,和少數(shù)歐洲組織。
復雜的條例
Med-Tech新聞最近的一篇文章概述了歐盟MDR的一些最大挑戰(zhàn),即歐盟新MDR和IVDR的四大挑戰(zhàn),包括重新分類設(shè)備的問題;更高的臨床檢測要求;公告機構(gòu)的需求增加;以及強調(diào)后市場監(jiān)測。
我們的專家認為,Med-Tech所提出的四個挑戰(zhàn)是行政責任,而真正的問題則更加根深蒂固。
Stobie:我們看到的是一些更深入的問題:包裝的適用性,并在無菌環(huán)境中的各級包裝上賦識別碼。這不是一個合規(guī)項目;這是商業(yè)行為的根本變化。
整個生產(chǎn)過程現(xiàn)在屬于更廣泛的立法范圍內(nèi)。它不僅僅是一個制造過程或臨床試驗過程,它是整個產(chǎn)品生命周期。
歐盟MDR這樣的法規(guī)在每個歐盟成員國都有法律約束力,并且將在規(guī)定日期生效。但是,在全球范圍內(nèi),存在差異,即使在公司內(nèi)部,醫(yī)療器械的類別也存在差異。
Stobie:有些部分是清楚的,有些部分仍然有待商議,每個公司需要有一個非常清晰的觀點,他們將怎么計劃他們的合規(guī)項目。
想要在全球分銷設(shè)備的制造商面臨額外的挑戰(zhàn),因為他們不僅需要遵守新的歐盟MDR,還需要遵守其他全球法規(guī)。在美國,該數(shù)據(jù)庫稱為全球UDI數(shù)據(jù)庫或 GUDID。向歐盟和美國供應產(chǎn)品的制造商需要在GUDID和EUDAMED中分別注冊其產(chǎn)品,實際上要執(zhí)行兩次相同的工作。將來,我們很可能會在其他國家(中國、日本、印度等)看到單獨的數(shù)據(jù)庫。
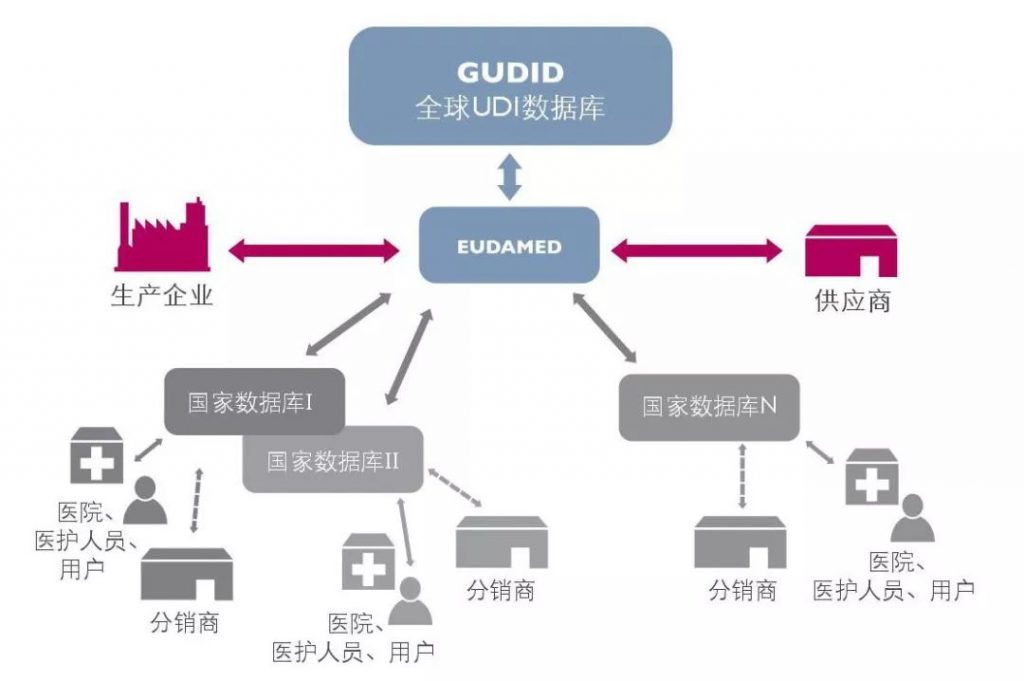
那么,制造商和公司可以做些什么來消除這種困惑呢?
說了那么多,關(guān)鍵點在于要與了解醫(yī)療器械領(lǐng)域的意見領(lǐng)袖密切交流,就能及時知曉信息。
Stobie:你有護理人員,有制造商,有醫(yī)療保健提供者,有賣醫(yī)療器械的人。在私人診所,還有應用于非緊急事由的私人醫(yī)療設(shè)備,這增加了更多的復雜性。
所以,和合適人員交流至關(guān)重要。制造商可以與已經(jīng)在美國通過GUDID注冊的公司和人員交流,來尋求建議。
也可以與公告機構(gòu)接觸,但這里引起進一步困擾的一件事是,公告機構(gòu)目前通過認證產(chǎn)品來盈利。因此,制造商能夠接觸多個公告機構(gòu)—如果一種醫(yī)療設(shè)備未被認證,他們可以選擇下一個機構(gòu)認證。
Watzke:這也需要再進行討論。在我看來,應該只為某些市場或產(chǎn)品設(shè)立一個公告機構(gòu)。公告機構(gòu)之間的競爭也會對病人的健康產(chǎn)生負面影響。
合肥依瑪擁有UDI相關(guān)噴碼標識類非常全面的設(shè)備及方案,如果您想了解有關(guān)歐盟MDR立法的含義及其如何影響您的業(yè)務(wù),請與我們聯(lián)系。我們的專家小組對歐盟的MDR有全面和透徹的了解,能夠為您提供如何快速、高效的合規(guī)的幫助和建議。